Пошарова топографія. Шкіра тильної поверхні пальців тонка, підошвової — щільна, особливо в ділянці проксимальної фаланги. Підшкірна жирова клітковина на тильній поверхні пальців розвинена слабко, на підошвовій пронизана сполучнотканинними перетинками та має виражену комірчасту будову. Тильний апоневроз пальців укріплений сухожилками м'язів-розгиначів які кріпляться до фаланг пальців. З підошвового боку сухожилки м'... Читати далі...
17:22 Морфологія порушень обміну речовин, дистрофії, некроз |
Термін "дистрофія" вперше запропонував В. В. Підвисоцький (1905). Дистрофія є загальнопатологічним процесом, що спостерігається при більшості захворювань залежно від їхньої етіології, патогенезу та клініко-морфологічних проявів. У її основі лежить порушення обміну речовин, що супроводжується змінами в організмі на різних рівнях його структурної організації.
Дистрофії об'єднують різноманітні якісні зміни тканини, що протягом тривалого часу трактувались як "переродження", "дегенерація". Разом з тим, у більшості випадків відсутнє будь-яке переродження тканини у власному розумінні цього терміна, а мова йде лише про нагромадження в ній тих або інших речовин. Так, у більшості посібників з патологічної анатомії пишуть про ослизнування проміжної тканини, пухлин. Однак електронномікроскопічними дослідженнями встановлено, що це не відповідає дійсності, бо в даному випадку мова йде про первинне ослизнування волокнистих структур сполучної тканини, а не про виділення слизу у міжклітинне середовище патологічно (дистрофічно) зміненими сполучно-тканинними клітинами (Д. С. Саркісов, 1988).
Треба також зауважити, що не всякі зміни слід обов'язково розглядати як дистрофічні, бо вони можуть відображати не тільки порушення в роботі клітини, але й такий її стан, що за своєю суттю не є патологічним, а пов'язаний з конкретними умовами життєдіяльності її систем. Зараз встановлено, що морфологічні зміни клітини, які розглядаються як дистрофічні, можуть відображати як її пошкодження та порушення її функції, так і, навпаки, виникати як результат підвищеної функціональної активності. Відповідно до цього в першому випадку виявлені зміни можна розглядати як "власне дистрофічні", у другому — як "дистрофічні" тільки формально, бо по суті це є процеси пристосувального характеру. У зв'язку з цим виникає необхідність "...виключення із групи тканинних дистрофій змін, що відображають морфологію посиленого функціонування (гіперфункція) і характеризуються подібними до дистрофічних ультраструктурними змінами, але супроводжуються не пригніченням, а підвищенням активності відповідних ферментів. Ультраструктурна морфологія гіперфункції повинна бути віднесена до категорії компенсації, в основі якої лежить внутрішньоклітинна регенерація та гіпертрофія" (В.В. Сєров, B.C. Пауков, 1975). Але якими б пристосувальними, відмінними від власне дистрофічних, не вважалися структурні зміни, в умовах інтенсифікації функції клітина "робить" все для того, щоб забезпечити їх таким шляхом, який би не супроводжувався розвитком цих структурних змін (Саркісов Д.С., 1988). При нормальній життєдіяльності клітини два основні її компоненти — асиміляція та дисиміляція — не дуже помітні, в умовах же патології вони стають чітко вираженими. Це пов'язано з тим, що при будь-якій формі дистрофій поряд з пошкодженням ультраструктур клітини і появою в її цитоплазмі різноманітних речовин постійно можна спостерігати ознаки посиленого синтезу та новоутворення ультраструктур, що спрямовані на компенсацію тих порушень, які виникають. Характерною особливістю дистрофічного процесу на цьому етапі є те, що підтримання клітинами функціональної активності, необхідної для продовження роботи хворого органу, забезпечується не тільки гіперфункцією ультраструктур ядра та цитоплазми. Ще більше значення має те, що практично одночасно з початком дії патогенного фактора (при появі дистрофічних змін) включається протилежно спрямований процес внутрішньоклітинної регенерації для забезпечення порушеного клітинного гомеостазу. Цей процес має універсальний характер і спрямований на забезпечення нормалізації структури та функції дистрофічно зміненої клітини, тобто розвитку зворотного характеру дистрофії. Питання це не до кінця вирішене. Загальноприйнято, що на ранніх етапах дистрофія має зворотний характер. Однак питання про те, де межа, за якою зворотна дистрофія стає незворотною залишається відкритим. Це пов'язано з рядом об'єктивних причин.
У першу чергу, це стосується високої лабільності субклітинних систем, що легко пошкоджуються при навіть оптимальних змінах умов їхньої енергозабезпеченості. Розрізняють три функціональні групи зазначених систем: 1. Трансформуючого типу (мітохондріальний апарат): каталізує трансформацію енергії та її акумуляцію в макроергичних сполуках (АТФ). 2. Реплікуючого типу (пластинчастий комплекс, зерниста цитоплазматична сітка, рибо- та полісоми): каталізує реплікацію білків та інших біополімерів, а також бере участь у процесах внутрішньоклітинного транспорту речовин ("внутрішньоклітинний конвеєр"). 3. Інтегровані метаболічні системи (клітинні гранули): каталізують мультиензимні синтетичні процеси та процеси транс- ендотеліального транспорту рідини, хімічних сполук. Основою перелічених систем є мембранні утворення, що становлять 2/3 ваги органоїдів клітини. Завдяки наявності мембран стає можливим поділ клітини на окремі секції, структурно ізольовані одна від одної, але функціонально тісно між собою пов'язані. Завдяки цьому з'являється можливість незалежного розвитку в цитоплазмі двох часто зовсім протилежних процесів (наприклад, парціальний некроз та внутрішньоклітинна регенерація). У той же час, ряд компонентів перелічених систем, особливо білки, що перебувають в ізоелектричному стані, при певних функціональних змінах ритмів метаболічних процесів легко коагулюють. При цьому аналогічні зміни можна спостерігати і в міжклітинному середовищі. Тому є всі підстави вважати, що внутрішньоклітинні та позаклітинні структури в умовах нормальної життєдіяльності організму весь час перебувають у стані "постійно загрозливої рівноваги". В даних умовах лабільність так званої норми відображає широкий діапазон реакцій клітини та її мікросередовища у відповідь на зміни умов їх взаємного існування. На цей аспект проблеми звертали увагу ще в середині XIX ст. Зокрема, висловлювалась думка, що ті зміни клітин, які розглядаються як дистрофічні, не завжди є такими, бо можуть відображати не тільки порушення в роботі клітини, а й такий функціональний стан, який за своєю суттю не є патологічним. У сучасних умовах питання про те, які зміни клітин слід вважати патологічними, а які — фізіологічними, зберігає свою актуальність. Правильне вирішення цього питання стає можливим, якщо виходити з того, що всі зміни клітинних та позаклітинних структур при збереженні ними основних життєвих властивостей слід розглядати як процеси реактивності, тобто фізіологічні, які розвиваються в інших умовах. Необхідно підкреслити, що патологічні процеси, що належать до дистрофій, відрізняються від фізіологічних проявів життєдіяльності клітин тим, що їхня інтенсивність виходить далеко за межі так званої норми, або ж тим, що вони виявляються в інших місцях чи в незвичайні періоди часу. В цьому проявляється особлива якість патологічних проявів життєдіяльності клітини. Значення процесів, що можуть бути віднесені до патологічних (дистрофічних), буває різним. В одних випадках мова йде про незначні зміни тканини, що не супроводжуються порушеннями її життєдіяльності; в інших — "дистрофічні" зміни збігаються, а інколи викликають такі пошкодження тканини, що призводять до зниження її функції. У подальшому, залежно від ступеня пошкодження (альтерації), відбувається вмирання (некроз) тканинних елементів або ж, при зміні умов, що викликають порушення обміну речовин, спостерігається відновлення попереднього стану. В обох випадках має місце порушення трофіки, або процесів живлення. Трофіка — це сукупність механізмів, що визначають метаболізм та структурну організацію клітини (тканини), які є необхідними для виконання ними спеціалізованих функцій (розмноження, виділення секрету, диференційовки, дихання, скоротливості м'язів та ін.) ( А.І.Струков, В.В.Сєров, 1993). Розрізняють клітинні та позаклітинні механізми трофіки.
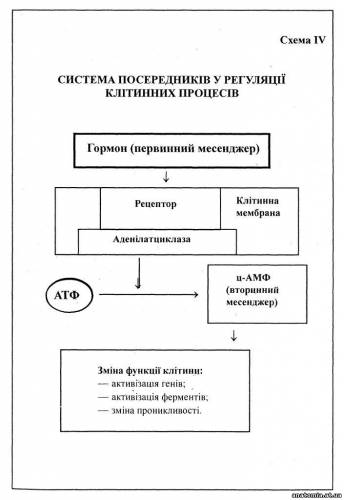
Клітинні механізми забезпечуються структурною організацією даної клітини і значною мірою є властивістю самої клітини як складної саморегулюючої системи. Позаклітинні механізми забезпечують процеси життєдіяльності клітини шляхом регуляції її зв'язків з навколишнім середовищем у межах цілісного організму Мова йде про транспортні (кров, лімфа, мікроциркуляторне русло ) та інтегративні (нейроендокринні, нейрогуморальні) системи регуляції трофіки. В умовах нормальної життєдіяльності клітини зазначені механізми забезпечують синхронну взаємодію органоїдів, макромолекулярних комплексів, дрібних молекул, що діють не ізольовано, а в тісних стосунках один з одним, тобто вся їхня робота чітко координована. Подібну узгодженість у роботі структур клітини називають інтеграцією. В основі її лежить тісна взаємодія внутрішньоклітинних та позаклітинних факторів, зокрема первинних та вторинних "месенджерів" (схема IV). Слід зазначити, що навіть у нормальних умовах можливі певні коливання в ступені інтеграції. Інакше кажучи, у функіонуванні всіх біологічних процесів, як пишуть А. Полікар та ін. (1970), можуть відбуватися розлади, зокрема, це стосується мутацій. В основі цього процесу лежить втрата репресорів — речовин, що в умовах нормальної життєдіяльності клітини забезпечують узгодженість дій її різноманітних комплексів, які формують певну макромолекулярну популяцію.
В умовах дії патогенних агентів у клітині відбувається пошкодження генів — репресорів, що забезпечують "координоване гальмування" функцій різноманітних ультраструктур, а це в свою чергу призводить до дисбалансу у взаємодії останніх. У результаті цього в клітині підвищується функція одних ферментів, знижується або повністю зникає функція інших, тобто розвивається ферментопатія. Іншими словами, втрата клітиною репресорної функції є одним із важливих проявів пошкодження (альтерації). Як правило, вона супроводжується порушенням внутрішньоклітинних механізмів трофіки, появою дистрофії, розвитком парціального або тотального некрозу. Альтерація має екзогенне або ендогенне походження. Вона виникає як результат тісної взаємодії структури та функції, що на рівні молекулярних та супрамолекулярних комплексів тісно взаємозв'язані.
У першому випадку функціональні порушення в клітині викликають пошкодження її структур в результаті дії патогенних агентів, у другому — функціональні порушення в клітині можуть мати спонтанний характер, і супроводжуватись пошкодженням ультраструктур, тобто порушення ці безпосередньо не пов'язані з дією факторів міжклітинного середовища. Забезпечення життєдіяльності клітини визначається відповідними механізмами трофіки, в основі яких лежить сукупність необхідних умов для нормального перебігу процесів енергетичного та основного обміну. В першому випадку відбувається звільнення та кумуляція енергії структурами клітини в процесі виконання нею спеціалізованих функцій; реакції ці пов'язані в основному з мітохондріями і виконуються поліферментними комплексами в процесі тканинного дихання. У другому випадку (основний обмін) — використовується тільки та кількість енергії, яка необхідна для підтримання нормальних функцій клітини (і організму в цілому) при мінімальних процесах обміну речовин.
Як відомо, в мембранах мітохондрій є повний набір ферментів дихального ланцюга і окисного фосфорування, а в матриксі органел міститься більшість ферментів циклу Кребса. Крім того, в мембранах мітохондрій є також контрактильні білки (подібні актоміозиновому комплексу), що зумовлюють скорочення та розслаблення органел. При скороченні та розслабленні мембран змінюється їхня проникливість і таким чином відбувається регуляція процесів обміну мітохондрій з гіалоплазмою.У цитоплазмі відбуваються процеси вільного окислення речовин у вигляді анаеробної та аеробної фаз. Перетворення енергії завжди розпочинається з анаеробної фази. В цій стадії при окисленні жирних кислот утворюється оцтова кислота, що в умовах гіпоксії переходить в ацетонові тіла, а при достатньому вмісті кисню — окислюється в циклі Кребса до води та вуглекислого газу. Слід зауважити, що окисне фосфорування відбувається тільки в мітохондріях, а вільне окислення речовин — на їхній поверхні. Ступінь вираженості енергетичних процесів у клітині забезпечується існуванням позаклітинних механізмів та системи їх регуляції. Це зумовлено існуванням в міжклітинному середовищі різноманітних гуморальних факторів — вітамінів, гормонів, продуктів обміну, іонів та ін. Збільшення або зменшення концентрації зазначених речовин регулюється діяльністю нервової та ендокринної систем і може по- різному впливати на забезпечення енергією внутрішньоклітинних структур в умовах нормальної життєдіяльності клітини та при дії на неї патогенних агентів. Однією з форм порушення процесів позаклітинної регуляції трофіки є роз'єднання процесів окислення та фосфорування, що, як правило, супроводжується гіперпродукцією енергії. Це спостерігається при збільшенні у міжклітинному середовищі дифтерійного токсину, продуктів життєдіяльності стафілококів, тироксину та ін. Порушення концентрації іонів натрію, кальцію в свою чергу супроводжується змінами проникливості плазмалеми, нагромадженням води в гіалоплазмі і, як результат, дистрофічними і навіть некротичними змінами окремих органел, що може закінчуватись некрозом всієї клітини. Таким чином, безпосередньою причиною дистрофії є порушення як клітинних, так і позаклітинних механізмів трофіки. Порушення ауторегуляції клітини супроводжується розвитком її енергетичного дефіциту і появою ферментопатії, що є основною патогенетичною ланкою при становленні та розвитку дистрофічного процесу. Порушення позаклітинних механізмів лежить в основі розвитку дисциркуляторних дистрофій (основна патогенетична ланка — гіпоксія), нервових (церебральних) дистрофій (основна патогенетична ланка — порушення нервової регуляції трофіки) та ендокринних дистрофій (основна патогенетична ланка — порушення ендокринної регуляції трофіки). Можливо, зазначена інтерпретація різних видів дистрофії і заслуговує на увагу з точки зору нових підходів до цієї проблеми, але, на сьогоднішній день принципово новим є те, що в основі будь-якої форми дистрофії лежить ферментопатія. Виходячи з цього положення, стає очевидною умовність і навіть "застарілість" традиційного розподілу дистрофій на білкові, жироввуглеводні та ін. (Д.С. Саркісов, 1988). Така класифікація, дійсно, відображає лише зовнішні морфологічні ознаки цього процесу, не пояснюючи його тонких внутрішніх (біохімічних) механізмів. Вона базується на оцінці різного характеру речовин, що з'являються в клітині (ліпіди, вуглеводи та ін.), тобто на кінцевих продуктах біохімічних реакцій, а не на розумінні того, чому і як з'явились ці речовини в клітині. Більше того, сьогодні вже давно не визнають можливості ізольованого порушення білкового, жирового та інших видів обміну, підкреслюється тісний взаємозв'язок усіх видів метаболізму. Можливо, тому так званій слизовій дистрофії до цього часу не можуть знайти в класифікації відповідного місця, відносячи її то до білкових, то до вуглеводних дистрофій. Виходячи із сучасних даних про дистрофії як ферментопатії, виділяють такі їх патогенетичні форми (Д.С. Саркісов, 1988): 1. Пошкодження клітини в результаті генетично зумовлених дефектів її ферментних систем (тезаурісмози). 2. Пошкодження клітини в результаті дії різноманітних (фізичних, хімічних, біологічних) факторів (різні типи отруєнь). 3. Пошкодження клітини в результаті функціонального перенавантаження її ферментних систем (гіперсекреція). 4. Пошкодження клітини в результаті спотворення функції її ферментних систем (амілоїдоз). У зв'язку із зазначеним, автор пропонує взагалі розглядати дистрофії як збірне поняття і відносити до нього тільки ті патологічні процеси, що мають у своїй основі пошкодження клітини, зі "зламом" її та зниженням функції, виключивши з "дистрофії" всі інші процеси, в етіологічному та патогенетичному аспектах принципово іншого походження. Разом з тим, Д. С. Саркісов підкреслює, що на даному етапі розвитку вчення про дистрофії ще не нагромаджено необхідної кількості фактичного матеріалу, достатнього для перегляду існуючої класифікації під кутом зору дистрофій як ферментопатій. З цим можна погодитись. Уся справа в тому, що здалеку нам завжди здається, нібито наука розвивається неперервно. Фактично ж її розвиток складається з поступального процесу пізнання окремих істин та помилок, тверджень та спростувань, правильних концепцій та неправильних узагальнень. Справедливість цього настільки очевидна, що вона інколи підмінює складність питань, які постають перед ученим, а вони, на жаль, постійно виникають при більш глибокому вивченні проблеми. Тому повертаючись до вище зазначеного, слід підкреслити, що формально дистрофії можна класифікувати:
I. Залежно від виду порушеного обміну речовин: 1. Білкові дистрофії (диспротеїнози); 2. Жирові дистрофії (ліпідози); 3. Вуглеводні дистрофії; 4. Мінеральні дистрофії. II. Залежно від локалізації процесу: 1. Паренхіматозні (клітинні); 2. Мезенхімальні (стромально-судинні, позаклітинні); 3. Змішані. III. Залежно від поширення процесу: 1. Загальні; 2. Місцеві. IV. Залежно від походження:
1. Спадкові; 2. Набуті. У розвитку дистрофій велике значення мають порушення позаклітинних механізмів трофіки, функція яких забезпечується існуванням транспортної (кров, лімфа, мікроциркуляторне русло) та інтегративної (нейроендокринна, нейрогуморальна) систем її регуляції. Залежно від порушення функції цих систем А. І. Струков, В.В.Сєров (1993) розрізняють: 1. Дисциркуляторні дистрофії;
2. Ендокринні дистрофії; 3. Церебральні дистрофії. Подібна класифікація має виражену клініко-анатомічну спрямованість і, з іншого боку, наближає нас до більш глибокого розуміння пато- та морфогенезу дистрофій.
Морфогенез дистрофій Основними ліорфогенетичними механізмами дистрофій є:
інфільтрація, спотворений синтез, трансформація, декомпозиція. Інфільтрація — це проникнення в клітину або позаклітинне середовище різноманітних речовин, що нагромаджуються в них у зв'язку з порушенням ферментативних систем, які не здатні забезпечити процеси їх утилізації (інфільтрація білками епітелію звивистих канальців при нефротичному синдромі, ліпоїдоз аорти при атеросклерозі, поява краплин жиру в гепатоцитах при жировому гепатозі та ін.).
Спотворений синтез характеризується порушенням внутрішньоклітинних синтетичних процесів, у результаті чого в клітинах та позаклітинному середовищі з'являються речовини, які в нормі тут не зустрічаються (поява тілець Малорі в гепатоцитах при алкогольному гепатиті, синтез глікогену в клітинах вузького сегменту петлі Генле при цукровому діабеті). Трансформація — це утворення продуктів одного виду обміну замість продуктів іншого виду обміну речовин (трансформація компонентів ліпідів та вуглеводів у білки, підвищення процесу полімерізації глюкози в глікоген). Цекомпозиція, в основі якої лежить порушення ультраструктурної організації клітини та позаклітинного середовища, що супроводжується нагромадженням у них продуктів розпаду (руйнування ліпопротеїдних комплексів мембран кардіоміоцитів при дифтерії, фібриноїдний набряк сполучної тканини при ревматичних хворобах). Основи раціонального харчування - http://profmed.org.ua/index/osnovi_racionalnogo_kharchuvannja/0-99
|
|
|
 |
Розділ: | Категорія: Топографічна анатомія нижньої кінцівки
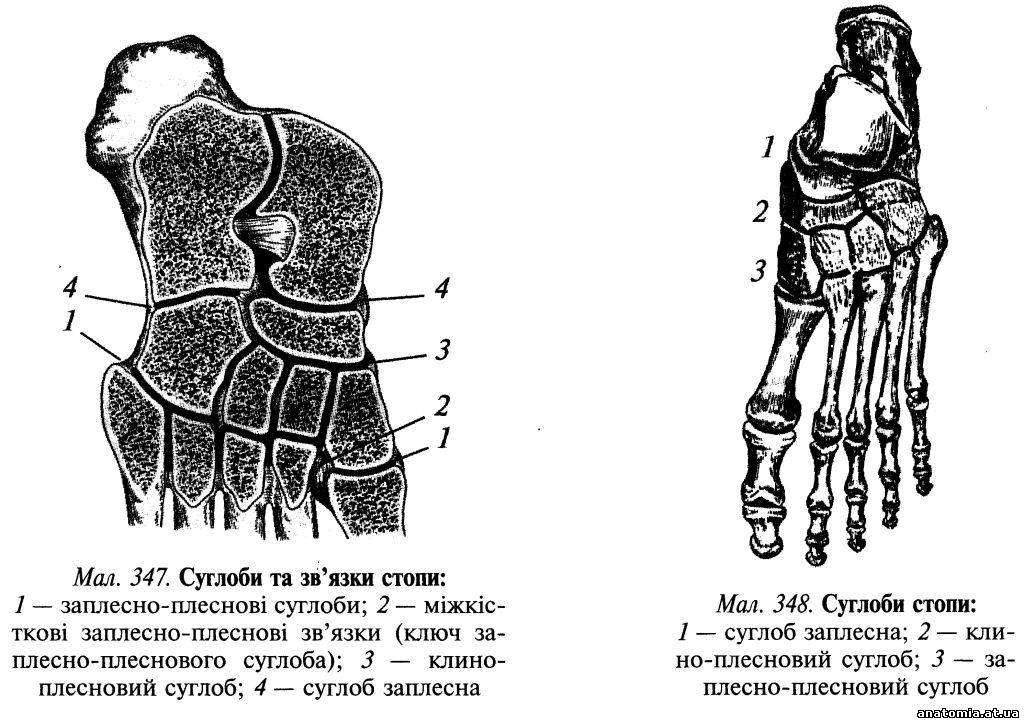 Пошарова топографія. Шкіра підошвової поверхні стопи товста та міцно зрощена з підлеглим підошвовим апоневрозом (aponeurosis plantaris) за допомогою великої кількості сполучнотканинних перегородок, які пронизують підшкірну жирову клітковину. Підшкірна жирова клітковина добре розвинена в ділянці п'яткового горба і головок плеснових кісток, де вона виконує роль амортизатора. Завдяки її вираженій комірковій будові нагнійні проц... Читати далі... |
Розділ: | Категорія: Топографічна анатомія нижньої кінцівки