Пошарова топографія. Шкіра тильної поверхні пальців тонка, підошвової — щільна, особливо в ділянці проксимальної фаланги. Підшкірна жирова клітковина на тильній поверхні пальців розвинена слабко, на підошвовій пронизана сполучнотканинними перетинками та має виражену комірчасту будову. Тильний апоневроз пальців укріплений сухожилками м'язів-розгиначів які кріпляться до фаланг пальців. З підошвового боку сухожилки м'... Читати далі...
14:07 Патологія поверхневого комплексу |
Поверхневий комплекс клітини складається з трьох частин: надмембранного компонента, клітинної мембрани, тобто плазмолеми (плазматичної мембрани), та підмембранного компонента.
Надмелгбранний комплекс або глікокалікс наявний практично у всіх клітинах, але ступінь його вираженості буває різним. Особливістю глікокаліксу клітин є висока швидкість відновлення. Цим пояснюєтся широка функціональна та філогенетична пластичність систем поверхневих структур. В утворенні глікокаліксу беруть участь олігосахаридні ланцюги глікопротеїнів і гліколіпідів, кислі глікозаміноглікани, сіалові кислоти. Глікокалікс, перебуваючи в безпосередньому контакті з зовнішнім середовищем, має важливе значення в рецепторній функції поверхневого апарату клітини, тому що надмембранний компонент рецепторів входить до складу глікокаліксу і за своєю природою є глікопротеїн. Рецептори здатні вільно переміщуватись як по поверхні клітинної мембрани, так і всередині її (так звана латеральна дифузія рецепторів) або мати обмежену рухливість. Вони спеціалізовані для сприйняття "сигналів" гормонів, багатьох біологічно активних речовин, антигенів, імуноглобулінів та їхніх фрагментів, компонентів комплементу і т. ін. Існують також рецептори щодо деяких вірусів. Механізм реалізації рецепторного сигналу достатньо універсальний, оскільки рецептори пов'язані з аденілагциклазою. Цей зв'язок являє собою трикомпонентну систему: рецептор, розміщений на зовнішній поверхні мембрани, трансдуктор (фосфоліпіди) і каталізатор на її внутрішній поверхні (аденілатциклаза). Остання каталізує внутрішньоклітинне перетворення АТФ (аденозинтрифосфат) в ЦАМФ (циклічний аденозинмонофосфат), який є універсальним стимулятором клітинних ферментів. У зв'язку з тим, що саме рецептори виконують роль інформаторів клітини, вони відіграють важливу роль у запуску механізмів молекулярної відповіді клітини надію пошкоджуючих факторів. Останні можуть призводити до зміни рухливості рецепторів, їх перерозподілу на поверхні мембран, пошкодження складових компонентів (надмембранного, внутрішньомембранного або підмембранного). Надходження патогенної інформації в клітину в умовах порушення структури рецепторних комплексів викликає розвиток патологічного процесу, ступінь прояву і напрямок якого залежить від багатьох факторів. Порушення механізмів рецепції відіграє важливу роль у розвитку цілого ряду хвороб людини. Одні з них пов'язані з відсутністю або блокадою рецепторів клітини. Так, відсутність апо-, В- і Е-рецепторів у паренхіматозних та мезенхімальних клітинах веде до розвитку гомозиготної гіперліпопротеїнемії IIа типу, що відома також як сімейна есенціальна гіперхолестеринемія. Транплантація печінки із збереженням апо-, В і Е-рецепторів при гомозиготній гіперліпопротеїнемії знижує рівень холестерину в крові до норми, що супроводжується зменшенням проявів атеросклерозу та ішемічної хвороби серця. З вродженим дефектом рецепторів до Fc-фрагментів імуноглобулінів у мезангіоцитах пов'язують ідіопатичну мембранозну нефропатію. Блокаду рецепторів клітини часто викликають аутоантитіла. Виникає одна із різновидностей цитотоксичних реакцій — реакція інактивації й нейтралізації, що проявляється антитільними хворобами рецепторів. Зокрема, це міастенія, в розвитку якої беруть участь антитіла до ацетилхолінових рецепторів нервово-м'язової пластинки, а також резистентний до інсуліну цукровий діабет, при якому антитіла проти клітинних рецепторів до інсуліну блокують ці рецептори не дозволяють клітині відповідати на інсуліновий сигнал. Пошкодження - функції рецепторів на поверхні В- і Т-лімфоцитів призводять до недостатності імунної системи організму. З функцією надмембранного клітинного шару пов'язана і властивість клітин до адгезії. Наявність на поверхні клітини білкових молекул клітинної адгезії (МКА) забезпечує процеси морфогенезу (формування тканин, органів, систем). Зміна структури МКА призводить до порушень морфогенезу в період ембріонального розвитку людини, або викликає розвиток деяких захворювань. Плазматична мембрана (плазмолема). Основним структурним компонентом поверхневого апарату є плазматична мембрана (плазмолема), або зовнішня клітинна мембрана. Вона найбільш стійка і є універсальною для всіх клітин. Основу її складає ліпопротеїновий комплекс. Кількість білків, ліпідів і вуглеводів може варіювати: ліпідів 35-40%, білків 55-60%, вуглеводів 5-10%. Плазматична мембрана має рідинно-мозаїчний принцип будови, тобто фосфоліпіди утворюють суцільний подвійний шар, в який частково або повністю занурюються молекули білків. Існує три різновиди білків: інтегральні, напівінтегральні і периферичні. Периферичні білки розміщуються на поверхні біліпідного шару, зв'язані з полярними головками ліпідних молекул електростатичними зв'язками і не утворюють суцільного шару. Ці білки зв'язують мембрану з її надмембранним шаром або субмембранними системами поверхневого апарату клітини. Глобули інтегральних білків пронизують всю товщину мембрани. їх гідрофобна частина занурена в гідрофільну частину ліпідної фази. У напівінтегральних білків гідрофобні амінокислоти згруповані на одному з полюсів глобули, і, відповідно, глобули занурені в мембрану лише наполовину, виступаючи на зовні з однієї (зовнішньої чи внутрішньої) поверхні мембрани. Залежно від функції, яку вони виконують, розрізняють білки-ерменти, білки-рецептори, транспортні та структурні білки. До складу мембранних ліпідів входять фосфоліпіди та гліколіпіди. Серед ліпідів виділяють дві групи: структурні і регуляторні. Останні присутні в менших кількостях. Вони або регулюють рівень густини мембрани (завдяки холестерину), або беруть участь у реалізації окремих специфічних функцій інтегральних білків шляхом складної структурної взаємодії між білковими молекулами. Основними властивостями структурних ліпідів є вертикальне переміщення, коли молекули двох моношарів міняються місцями ("фліп-флоп"), але воно виникає значно рідше і набагато складніше, ніж латеральне зміщення. Морфологічною основою регуляції проникливості мембран для іонів є наявність у них особливих каналів, що мають високу специфічність до іонів кальцію, натрію, калію та хлору. Основною функцією плазматичної мембрани є транспорт речовин представлений у вигляді: а) дифузії (пасивний транспорт);
б) полегшеної дифузії; в) активного транспорту речовин через мембрану проти градієнту концентрації з використанням енергії за рахунок розщеплення АТФ. Проникнення макромолекул біополімерів відбувається, головним чином, за рахунок ендоцитозу.
Транспорт речовин за допомогою мембран поділяється на ендоцитоз (всередину клітини) і екзоцитоз (назовні її).
Існує три різновиди ендоцитозу: — фагоцитоз (часточки більше 1 нм);
— макропіноцитоз (часточки приблизно 0,2 — 0,3 нм); — мікропіноцитоз (в основному рідина). Суть процесу ендоцитозу полягає в тому, що при контакті часточок з клітиною, вони поглинаються мембраною, з утворенням ендоцитозного міхурця. Він відшнуровується від плазматичної мембрани і надходить всередину клітини, де зливається з лізосомою, яка виділяє гідролітичні ферменти. У цих процесах беруть участь усі три компоненти поверхневого апарату клітини.
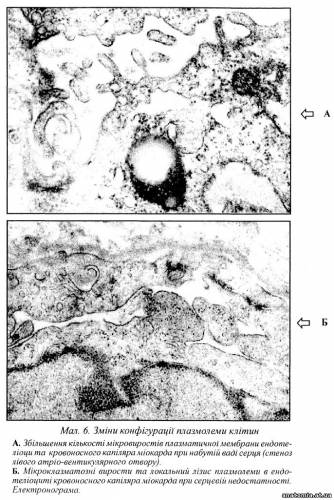
Реакції фагоцитозу і піноцитозу можуть виступати показниками цитофізіологічної активності клітини в умовах патології, а також використовуватися як діагностичні критерії активності патологічного процесу в клінічній патоморфології. Такими є сидерофаги ("клітини серцевих вад"), зернисті кулі, ксантомні клітини, клітини Вірхова, клітини Мікуліча та ін. Внаслідок активної резорбції метаболітів у клітині нагромаджуються субстрати, які важко піддаються утилізації, що призводить до розвитку дистрофії клітини. Порушення структури мембран умовно можна поділити на: транспортні, функціонально-метаболічні та структурні. Порушення транспортних функцій і, насамперед, збільшення проникливості мембран — універсальна ознака пошкодження клітини. У людини порушення транспортних функцій зумовлює більше двадцяти так званих "транспортних" хвороб (ниркова глікозурія, цистинурія, порушення всмоктування глюкози, вітаміну В12, спадковий сфероцитоз та ін.). Серед функціонально-метаболічннх процесів клітинних мембран центральними є зміни процесів біосинтезу, а також різні відхилення в енергозабезпеченні живих систем. Структурні пошкодження мембрани головним чином пов'язані зі змінами її конфігурації (мал.6).
Останні можуть бути зумовлені змінами ригідності в деяких її ділянках, що в свою чергу залежить від вмісту в мембрані холестерину. Якщо фосфоліпіди перебувають нижче температури їх фазового переходу, то вуглеводні ланцюжки фосфоліпідів будуть відносно ригідними або гелеподібними. При цьому холестерин проявляє "розріджувальну" дію і збільшує текучість мембран. Коли ж фосфоліпіди перебувають вище температури переходу, то текучість мембрани зменшується. Таким чином, холестерин відіграє подвійну роль у різних ділянках однієї й тієї самої мембрани: в одних випадках це утворення кристалічних гелеподібних зон, а в інших — більш рідких, рідка-кристалічних зон, що пригнічує рух відносно ненасичених фосфоліпідів.
Розрізняють такі зміни плазматичних мембран: 1. Надмірне везикулоутворення ("мінус-мембрана") з подальшим злиттям дрібних везикул у великі пухирі та порожнини. В деяких випадках при набряку клітини мікровезикули можуть мати переважно крайове розташування на плазмолемі, що є ознакою значного набухання клітин і, відповідно, її плазмолеми. При подальшому зростанні набряку повністю використовується резерв плазматичної мембрани, порушується її цілісність, що закінчується загибеллю клітини. Необхідно звернути увагу на те, що за допомогою мікропіноцитозних везикул в клітину можуть проникати віруси. 2. Збільшення поверхні плазмолеми за рахунок мембран мікропіноцитозних везикул, що є ознакою різкого набухання клітини. Загальна поверхня плазмолеми натягується і в цілому збільшується ("плюс-мембрана"). 3. Утворення мікроклазматозних виростів. Мікроклазматоз та клазматоз є відокремленням частини цитоплазми, оточеної по периметру плазматичною мембраною, з подальшим її розпадом та наступною реутилізацією в позаклітинному середовищі. Посилення цих явищ відбувається під дією різних факторів. Денатуровані ділянки цитоплазми, які відокремились від неї в результаті мікроклазматозу, можуть індукувати утворення антитіл, тобто стати аутоантигенами. 4. Формування клітинними мембранами складок, цитоплазматичних відростків, інвагінацій та пухирців. Усе це може бути пов'язане зі змінами електричних зарядів на клітинній мембрані й залежить від її молекулярного складу. 5. Потовщення структурних компонентів мембранного комплексу як результат порушення проникливості мембран. Однією з причин цього явища може бути зменшення іонів кальцію в міжклітинній рідині, що приводить до зміни в натрій-калієвому обміні, внаслідок чого в клітині накопичується рідина. Другою причиною може бути вивільнення фосфоліпідів зі складу мембрани в результаті дії фосфоліпаз.
6. Утворення в плазмолемі широких мікропор, У нормі ширина мікропор не перевищує 0,4-0,6 нм, при пошкодженнях обмінної дифузії в клітині вони можуть досягати 9 нм, що призводить до ізоосмотичного набухання клітини, її перерозтягування і в подальшому — до розриву її мембрани. 7. Локальні пошкодження плазматичної мембрани, розмір яких може досягати 1 мкм. Вони пов'язані як з лізисом мембран, так і з пошкодженням фосфоліпідів у результаті дії фосфоліпаз або значної кількості перекисів ліпідів. Пошкодження плазмолеми призводить до розладу активного мембранного транспорту: концентрація інтратаекстрацелюлярного натрію та калію вирівнюється, у клітину проникають низькомолекулярні аніони, а потім і катіони, підвищується внутрішньоклітинний осмотичний тиск. Структурним проявом порушення водно-електролітного обміну є набухання та набряк клітини. Зміни активного мембранного транспорту можуть призвести також до вибіркового проникнення в клітину деяких продуктів обміну (білків, ліпідів, вуглеводів, пігментів) і накопичення їх після виснаження ферментних систем, які метаболізують ці продукти. Так розвиваються клітинні дистрофії інфільтраційного генезу (жирова дистрофія гепатоцитів при гіперліпідеміях; гіаліново-крапельна дистрофія нефроцитів при нефротичному синдромі). При значному пошкодженні плазмолеми і проникненні в клітину токсичних або біологічно активних речовин можлива деструкція клітини з вивільненням хімічних речовин, які входять до їх складу (білків, ліпідів та ін.). Це веде до їхнього накопичення в клітині. У цих випадках виникають клітинні дистрофії декомпозиційного генезу (жирова дистрофія міокарда при дифтерії, гідропічна дистрофія гепатоцитів при вірусному гепатиті). Інфільтраційний механізм при розвитку дистрофії може змінюватися декомпозиційним. В окремих випадках при пошкодженні плазмолеми в цитоплазму проникають речовини, які порушують синтез того чи іншого метаболіту, внаслідок чого виникають різні види клітинних дистрофій. При значних пошкодженнях плазмолеми наступає некроз клітини. Підмембранний компонент є третім структурним компонентом поверхневого мембранного комплексу, який контактує з внутрішньої сторони клітини з плазматичною мембраною (підмембранний, або субмембранний шар). Фактично це периферична спеціалізована частина цитоплазми, в якій сконцентровані ферментативні системи, які забезпечують процеси трансмембранного транспорту і рецепції, а також здійснюють загальні процеси внутрішньоклітинного метаболізму. В структурному плані опорно-скорочувальна система субмембранного апарату є спеціалізованою частиною загальної внутрішньоклітинної опорно-скорочувальної системи цитоплазми ("скелет" клітини) і, в зв'язку з тим, що він представлений мікрофіламентами (фібрилами) та мікротрубочками, патологічні зміни підмембранного шару пов'язані саме з цими структурами. Мікрофіламенти (лат. microfilamentum) — немембранні органели загального призначення. В деяких спеціалізованих типах клітин вони можуть виконувати роль органел спеціального призначення. Існують три основні типи мікрофіламентів: 1. Актинові мікрофіламенти, що складаються з білка актину, мають діаметр 5-6 нм. Беруть участь у механізмах клітинного скорочення і виявляються в різних клітинах організму. 2. Міозиновімікрофіламенти, що складаються з білка міозину, мають діаметр 10 нм і забезпечують процеси скорочення. 3. Проміжні мікрофіламенти, що складаються в різних клітинах зі специфічних білків, мають діаметр 10-15 нм. Так, у клітинах епітелію — це кератин, у клітинах сполучної тканини — виментин, у гладеньких міоцитах травної, дихальної, сечостатевої систем — скелетин і т. ін. У спеціалізованих клітинах мікрофіламентів багато, вони утворюють пучки складної будови (тоно-, міо-, нейрофібрили) і є органелами спеціального призначення. Патологія мікрофіламентів досить різноманітна. З їхньою дисфункцією пов'язують, зокрема, деякі види холестазу, а також первинний біліарний цироз печінки. Вважають, що циркуляція жовчі в печінці регулюється мікрофіламентозною системою, оскільки мікрофіламенти у великій кількості оточують жовчні канальці і, прикріплюючись до плазматичної мембрани гепатоцитів, можуть змінювати їхній просвіт. При дії на мікрофіламенти факторів, які пригнічують їхню здатність скорочуватись, відбувається застій жовчі. Різке збільшення мікрофіламентів спостерігається в епітелії жовчних протоків при первинному біліарному цирозі, що може бути причиною порушення кінетики біліарної системи, холестазу і наступного гранульоматозу холангіол, характерного для цього захворювання. Збільшення кількості мікрофіламентів спостерігається в клітинах злоякісних пухлин, особливо в зонах інвазії. Мікрофіламентозна активність характерна також для ряду репаративних процесів, наприклад, при загоюванні ран. Пошкодження мікрофіламентів у кардіоміоцитах та гладких міоцитах призводить до змін контрактильних властивостей цих клітин.
З патологією проміжних філаментів, переважно їх акумуляцією, пов'язують багато патологічних процесів: утворення алкогольного гіаліну (тільця Мелорі), нейрофібрилярних сплетінь в нейроцитах та сенільних бляшок при хворобі Альцгеймера; скупчення мікрофіламентів при деяких формах кардіоміопатій. Накопичення алкогольного гіаліну з характерною ультраструктурою в клітинах епітеліального та мезенхімального походження є морфологічним маркером хронічного алкоголізму
Мікротрубочки (лат. microtubulus) — немембранні органели загального, а в деяких випадках спеціального (джгутики, або війки) призначення. Вони виконують різноманітні функції: опорну, формуючи цитоскелет клітини; транспортну, забезпечуючи транспорт макромолекул; секреторну; а також беруть участь у мітотичному поділі клітин і забезпечують переміщення органел. Мікротрубочки утворюються внаслідок полімеризації молекул тубуліну. Часткова або повна деполімеризація мікротрубочок чи пошкодження процесів з'єднання тубуліну може відбуватись під впливом різних факторів (низької температури, високого тиску, дії алколоїдів та ін.). Так, наприклад, при дії на клітину алколоїду колхіцину порушується процес самоскладання мікротрубочок, вінбластин викликає перехід тубуліну в кристалоподібні структури, тим самим перешкоджаючи утворенню мікротрубочок, що дає підстави для використання його з метою лікування деяких злоякісних новоутворень, як фактора, здатного гальмувати мітоз. До тяжкого пошкодження мікротрубочок призводить іонізуюче випромінювання. При цьому різко зменшується їхня кількість, виникають патологічні форми мітозів. При дії алкоголю також зменшується кількість мікротрубочок (особливо в гепатоцитах), вони змінюють форму і поступово витісняються проміжними філаментами. Патологія мікротрубочок може бути основою деяких клініко-морфологічних синдромів. Так, наприклад, синдром нерухомих війок (вроджений синдром Картагенера), при якому війки епітелію дихальних шляхів і слизової оболонки середнього вуха стають малорухомими. У нормі війки рухаються в результаті переміщення дублетів мікротрубочок, завдяки наявності в ручках білка динеїну. Недостатність або відсутність цього білка різко послаблює мукоцелюлярний транспорт або ж він повністю припиняється, що призводить до хронічного запалення дихальних шляхів і середнього вуха. У таких хворих виникає безпліддя, бо стають нерухомими сперматозоїди, хвости яких еквівалентні війкам. |
|
|
 |
Розділ: | Категорія: Топографічна анатомія нижньої кінцівки
 Пошарова топографія. Шкіра підошвової поверхні стопи товста та міцно зрощена з підлеглим підошвовим апоневрозом (aponeurosis plantaris) за допомогою великої кількості сполучнотканинних перегородок, які пронизують підшкірну жирову клітковину. Підшкірна жирова клітковина добре розвинена в ділянці п'яткового горба і головок плеснових кісток, де вона виконує роль амортизатора. Завдяки її вираженій комірковій будові нагнійні проц... Читати далі... |
Розділ: | Категорія: Топографічна анатомія нижньої кінцівки